Consideraciones prácticas#
Le recomendamos consultar Microtutor y MyScope para obtener explicaciones interactivas de muchos de estos conceptos.
Selección de objetivos#
Los objetivos del microscopio tienen una serie de características que deben tenerse en cuenta al decidir qué objetivo es el adecuado para su experimento.
Aumento y resolución: cuanto mayor sea la apertura numérica (NA) de la lente, más fina será la resolución que se puede obtener en la muestra. El NA se calcula como \(NA=RI * sin(θ)\), en relación con el índice de refracción de la muestra, el vidrio y medios de inmersión, así como el rango de ángulos de luz emitida que se pueden recoger en la lente. A menos que se utilicen técnicas especiales, el límite típico de resultado se calcula como \(d = λ / 2NA\), lo que significa que la resolución se establece tanto por la NA de la lente como por la longitud de onda de la luz utilizada para la imagen.
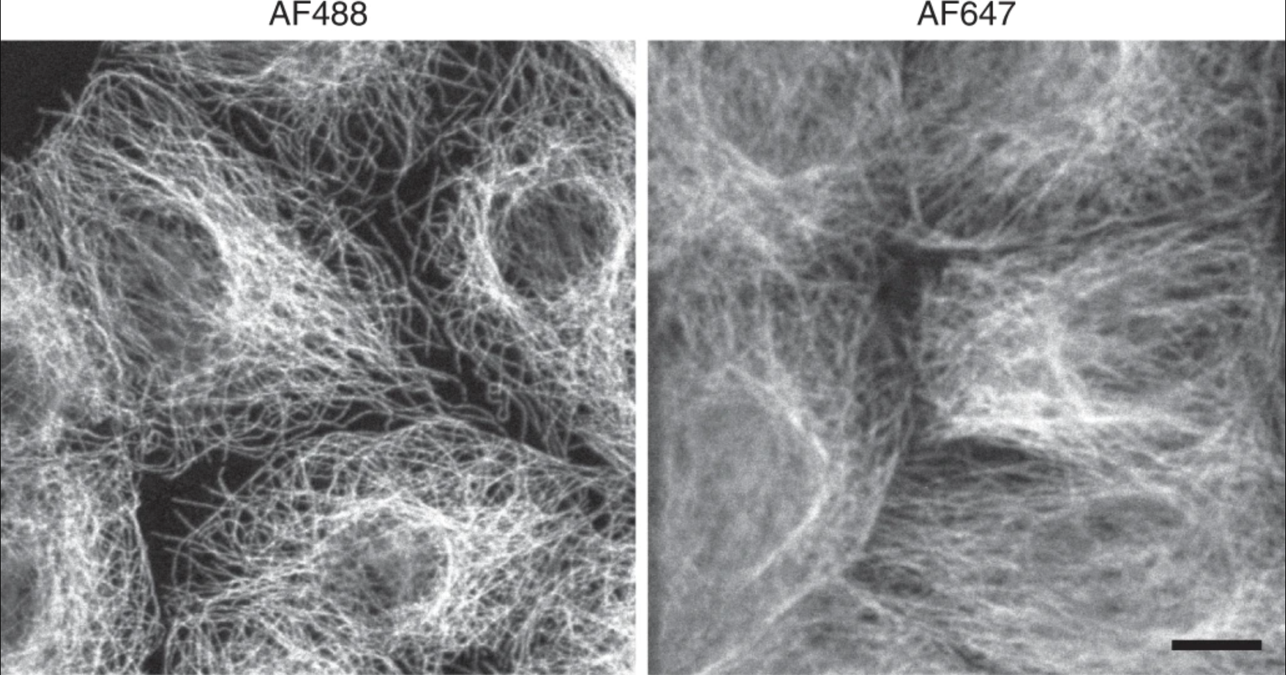
Figura 5 Resolución reducida en longitudes de onda de luz más largas. Los microtúbulos fotografiados con una longitud de onda de luz más corta muestran una resolución más alta que los fotografiados con longitudes de onda más largas. Adaptado de Jonkman J., Brown C.M., Wright G.D et al. Tutorial: orientación para la microscopía confocal cuantitativa. Nat Prot 15, (2020) 5#
Corrección de color: cuando se realiza una microscopía multicolor, es importante elegir una lente objetivo etiquetada como «Apo» o «Super Apo», ya que estas lentes se corrigen para enfocar de 3 a 6 colores en el mismo plano al mismo tiempo. Los lentes
Fluorgeneralmente enfocarán dos colores a la vez.Distancia focal: La distancia de trabajo o distancia focal (WD) da la distancia en milímetros que la lente puede enfocar en la muestra. Esta distancia incluye también el cubreobjetos y los medios de montaje. Si toma imágenes de una muestra gruesa y/o si necesita obtener imágenes lejos de la superficie de la muestra, es importante asegurarse de que la lente tenga una distancia de trabajo suficiente.
Conjuntos de filtros#
Es importante asegurarse de que el microscopio en el que desea obtener imágenes tenga los conjuntos de filtros correctos para los fluoróforos que desea utilizar. Consulte la sección sobre filtración para obtener más información.
Muestreo Z#
Si desea capturar varias secciones z, el espaciado de estas secciones es importante si desea poder realizar una reconstrucción 3D precisa. SVI tiene una [explicación matemática más completa de esto] (https://svi.nl/NyquistRate), así como una [calculadora en línea] fácil de usar (https://svi.nl/NyquistCalculator) que puede usar para calcular el espaciado óptimo de la sección z para sus condiciones de imagen.
Potencia de adquisición/velocidad#
La cantidad de señal capturada de cualquier fluoróforo estará relacionada no solo con el brillo intrínseco del fluoróforo, sino también con la cantidad de luz de excitación a la que está expuesto (debido a la duración, la potencia o ambos), así como con la cantidad de tiempo y la multiplicación de la señal que ocurre en el detector (típicamente una cámara o un tubo fotomultiplicador (PMT)). Un experimento óptimo suele ser uno que minimiza la cantidad de luz que llega a la muestra (para reducir el fotoblanqueo y/o la fototoxicidad) mientras se logra una señal fluorescente adecuada y en un tiempo mínimo en el equipo. Cómo equilibrar exactamente estos factores competitivos dependerá de la biología exacta que se estudie y de las limitaciones del investigador.
